Ciencias Agrarias / Agricultural Sciences
Cienc Tecn UTEQ (2020) 13(2) p 9-16
ISSN 1390-4051; e-ISSN 1390-4043
Rizobacterias con potencial antagonista in vitro a Mycosphaerella fijiensis Morelet
Rhizobacteria with potential antagonist in vitro to Mycosphaerella fijiensis Morelet
Karen Tatiana Chávez Arteaga1, Jefferson Javier Guato Molina2, Jorge Luis Rodríguez Acosta3a, Ángel Virgilio Cedeño
Moreira3b, Ricardo Fernando Romero Meza3c, Hayron Fabricio Canchignia Martínez4*
1Departamento Bionintanga, NINTANGA S.A. Panamericana Norte km 10, Latacunga, Ecuador. Código Postal: 050103. Mail:
(binintanga@nintanga.com.ec), Tel: (593-2) 3959 878, ORCID: 0000-0002-7615-2145
2Fincas Experimentales Nestlé, R&D. Tours, Quevedo, EC. Estación experimental (El Chollo), Valencia, El Vergel. Código
Postal: 121150. Mail: (jeffersong94@hotmail.com), Tel: (593-05) 999132067, ORCID: 0000-0002-6442-0149
3aLaboratorio de Microbiología Molecular del Departamento de Biotecnología, Universidad Técnica Estatal de Quevedo, km
1.5 a Santo Domingo de los Tsáchilas, EC. Código Postal: 120501. Mail: (jorgelaco.rodriguez@uteq.edu.ec), Tel: (593-05)
978990046, ORCID: 0000-0001-7207-8702
3bMail: (anvirced125.55@hotmail.com), Tel: (593-05) 999132067, ORCID: 0000-0002-6564-5569
3cMail: (ricarhapo@hotmail.com), Tel: (593-05) 0969347127, ORCID: 0000-0002-3915-3309
4*Laboratorio de Microbiología Molecular del Departamento de Biotecnología, Universidad Técnica Estatal de Quevedo, km
1.5 a Santo Domingo de los Tsáchilas, EC. Código Postal: 120501. Autor de correspondencia Mail: (hcanchignia@uteq.edu.
ec), Tel: (593-05) 091279346, ORCID: 0000-0003-1195-5446
Rec.: 13.05.2019. Acept.: 04.04.2020.
Publicado el 30 de diciembre de 2020
Resumen
Abstract
l empleo de bio-controladores en la agricultura beneficia los
he use of biocontrollers in agriculture benefits the
E
aspectos fisiológicos en plantas, a diferencia de la constante
T
physiological aspects in plants, unlike the constant
aplicación de pesticidas en el cultivo del banano ha ocasionado
application of pesticides in the cultivation of banana has caused
la pérdida de la sensibilidad en M. fijiensis, reduciendo la
the loss of sensitivity in M. fijiensis, reducing soil microbiota.
microbiota del suelo. El objetivo se enfocó en caracterizar el
The objective was to characterize the antagonistic potential
potencial antagónico de las PGPR en inhibición de germinación
of PGPR in inhibition of ascospore germination and mycelial
de ascósporas y desarrollo micelial de M. fijiensis. Se realizaron
development of M. fijiensis. Monosporic cultures of M. fijiensis
cultivos monospóricos de M. fijiensis e identificado por PCR.
and identified by PCR were performed. The cellular extracts
Se evaluaron los extractos celulares de Pseudomonas putida
of Pseudomonas putida PB3-6, Klebsiella variicola BO3-4,
PB3-6, Klebsiella variicola BO3-4, Enterobacter asburiae BA4-
Enterobacter asburiae BA4-19, Serratia marcescens PM3-
19, Serratia marcescens PM3-8, Enterobacter asburiae PM3-
8, Enterobacter asburiae PM3-14, Pseudomonas protegens
14, Pseudomonas protegens CHA0, Pseudomonas fluorescens
CHA0, Pseudomonas fluorescens WCS417, Pseudomonas
WCS417, Pseudomonas veronii R4 y Bacillus subtilis ATCC
veronii R4 and Bacillus subtilis ATCC 5540 were evaluated
5540 para sus evaluaciones antagonistas: a) Inhibición del tubo
for its antagonistic evaluations: a) Inhibition of the germination
germinativo de las ascósporas al 2% y b) Desarrollo micelial
tube of the ascospores at 2% and b) Mycelial development
al (2 y 10 %). La PCR empleado en la identificación de M.
at (2 and 10%). The PCR used in the identification of M.
fijiensis se confirma el producto de amplificación de 1018 pb.
fijiensis confirms the amplification product of 1018 bp. The
El factor antagónico de los extractos celulares al 2 % de PM3-
antagonistic factor of the cellular extracts at 2% of PM3-14 and
14 y CHA0 inhibe sobre el 80 % al desarrollo de los tubos
CHA0 inhibits over 80% the development of germ tubes. The
germinativos. La inhibición al desarrollo micelial del extracto
inhibition to the mycelial development of the cellular extract to
celular al 2 %, de CHA0 logró una efectividad del 54 % y las
2%, of CHA0 achieved an effectiveness of 54% and the strains
cepas (PM3-8, PM3-14 y BA4-19) con (32, 26 y 26 %). Al 10
(PM3-8, PM3-14 and BA4-19) with (32, 26 and 26%). 10%
% del extracto de la cepa PM3-8 inhibe el desarrollo micelial
of the extract of strain PM3-8 inhibited mycelial development
con niveles de turbidez de 0,47 (OD600nm). El empleo de estos
with turbidity levels of 0.47 (OD600nm). The use of these bio-
bio-controladores en la agricultura ofrecerá una alternativa para
controllers in agriculture will offer an alternative to benefit in
beneficiar en la reducción del uso de agroquímicos.
reducing the use of agrochemicals.
Palabras claves: Mycosphaerella fijiensis, rizobacterias,
Keywords: Mycosphaerella fijiensis, rhizobacteria,
actividad antagonista, extracto celular.
antagonist activity, cellular extract.
9
Chávez et al., 2020
Introducción
es de importancia para el sector agrícola de algunos
países de América.
as bananas comestibles como fruta fresca
La rizosfera de los cultivares tradicionales de
L
pertenecen al generó Musa acuminata, distribuidas
musáceas, exhibe gran diversidad de microorganismo
en las regiones tropicales y subtropicales del mundo
que son empleados como estrategias al control biológico,
(Aguilar y Kohlmann, 2006). En Ecuador al 2015 la
entre ellas, estas poblaciones de Pseudomonas spp.
producción de banano fue de 4.1 millón de toneladas
mantienen la estabilidad de los cultivos y ejercen
de 162,039 ha (Proecuador,
2016). La disminución
actividades antagonistas a sus enemigos naturales.
en producción de fruta se da por efecto del hongo
Donde el objetivo es caracterizar el potencial antagónico
ascomicete Mycosphaerella fijiensis Morelet (Sigatoka
de las PGPR en inhibición de germinación de ascósporas
negra) principal problema fitopatológico en el cultivo de
y desarrollo micelial de M. fijiensis.
banano y plátano en América, Asia y África, causando
pérdidas estimadas en 33 a 69 % al no controlarse la
Materiales y métodos
enfermedad (Marin, Romero, Guzmán, y Sutton, 2003).
Para el control de Sigatoka negra se realizan aplicaciones
a investigación se realizó en el Laboratorio
constantes de fungicidas de acción sistémica, siendo
L
de Microbiología y Biología Molecular de la
potencialmente perjudicial para el medio ambiente
Universidad Técnica Estatal de Quevedo
(UTEQ),
(Fu et al., 2010), y su continua aplicación ha llevado a
localizado en el Campus Universitario “Manuel Haz
generar resistencia M. fijiensis (Romero, 1995).
Álvarez” ubicado en el km 1.5 vía Quevedo - Santo
La resistencia del hongo a fungicidas como:
Domingo. Sus coordenadas geográficas son 01° 01” de
benomyl (Romero y Sutton, 1998), azoxystrobin (Amil,
latitud Sur y 79° 47” de longitud Occidental, ubicada a
Heaney, Stanger y Shaw, 2007) y trifloxystrobin (Pérez,
una altura de 73 msnm.
Hernández, Hernández y Pérez, 2002), se debe a su
empleo frecuente y extensivo de estos químicos para el
Selección y preparación de inoculó bacteriano
control de la enfermedad antes y después de la cosecha
Del Banco de Germoplasma del Laboratorio de
del banano. Aunque recientemente se han desarrollado
Microbiología de la UTEQ, fueron seleccionadas las
fungicidas eficientes como triazoles y procloraz, pero el
rizobacterias provenientes de cultivares endémicos de
uso excesivo da a lugar a residuos químicos en frutos y
Musáceas con su clasificación a metabolitos antagónicos
causan daños a la salud humana (Fu et al., 2010).
(Cuadro 1). Además, se emplearon dos cepas control P.
El sector agropecuario ha iniciado trabajos de
protegens CHA0 y P. fluorescnes WCS417 (donadas por
identificación y manipulación de PGPR, de la expresión
el Dr. Dieter Haas y Dr. Ientse van der Sluis) y Bacillus
en inglés Plant Growth Promoting Rhizobacteria, que
subtilis ATCC
5540 (donada por el Dr. Humberto
se destacan por sus capacidades simbióticas como:
Prieto). Las rizobacterias se incubaron en King B
Pseudomonas, Bacillus, Azotobacter y Azospirillum
líquido selectivo
[(g/L): peptona,
20.0; glicerol,
15
(Döbereiner, Baldani y Reis, 1995). Las bacterias al
mL; K2HPO4, 1.5; MgSO4 x 7H2O, 1.5; agar, 15; agua
género Pseudomonas spp son las más estudiadas, al
destilada (pH 7.2)], suplementado con chloramphenicol
tener la capacidad de producir metabolitos secundarios
(13 µg/mL), ampicillina (40 µg/mL) por 48 h (King et
y antibióticos que actúan como compuesto fúngicos:
al., 1954).
pioluteorina (Plt), pirrolnitrina (Prn), ácido fenazina-
1-carboxilico (PCA) y 2,4- diacetilfloroglucinol (2,4
DAPG) (Dwivedi y Johri, 2003). Los bio-controladores
Cuadro 1. Caracterización de los aislados bacterianos
reportados en inhibir el desarrollo o germinación de
a producción de metabolitos antagónicos
ascósporas M. fijiensis están enfocados al empleo de
Organismo
Cepas
Metabolitos
extractos celulares de plantas, donde la obtención de
antagónicos
un péptido antimicrobiano Ib-AMP4 e Ib-AMP2 de
PR
HCN
Prn
Impatiens balsamina inhibe el desarrollo micelial del
1
Pseudomonas putida
PB3-6
+
+
hongo y germinación de sus ascósporas
(Vasquez,
2
Klebsiella variicola
BO3-4
+
+
+
Guzman, Patarroyo y Arango, 2009). La aplicación
3
Enterobacter asburiae
BA4-19
+
de microorganismo es otra de las estrategias que se
4
Serratia marcescens
PM3-8
+
+
están incorporando al control de Sigatoka negra, donde
5
Enterobacter asburiae
PM3-14
+
+
+
Trichoderma spp nativas del Ecuador han demostrado
tener actividad antagonista a M. fijiensis in vitro
Productoras de metabolitos secundarios: PR-Proteasa,
(Galarza et al., 2015). Por lo tanto, la búsqueda de
HCN-cianuro de hidrogeno, Prn-pirrolnitrina.
nuevos agentes bio-controladores para Sigatoka negra
10
Ciencia y Tecnología. 2020. 13(2):9-16
Rizobacterias con potencial antagonista in vitro a Mycosphaerella fijiensis Morelet
Identificación de M. fijiensis
el porcentaje de inhibición micelial desde el borde del
Del tejido foliar de banano Cavendish infectado con
tarugo hasta el crecimiento del hongo por 6, 8 y 12 días
Sigatoka negra en los estadios 5 o 6, fueron colectados y
empleando la fórmula: % inhibición = (crecimiento del
segmentados en 10 cm2. Las muestras se limpiaron con
control - crecimiento del tratamiento / crecimiento del
hipoclorito al 1 % y ubicadas en cámaras húmedas por
control) x 100.
24 h para maduración de ascas y proceder a la descargar
Cinética de inhibición micelial del extracto al 10 %
de ascósporas. Muestras de hojas de 5 cm2 se fijaron al
en medio liquido Sabouraud, de discos miceliales de
interior de la tapa de la placa Petri para sus descargas
(0.5 cm Ø) se re-suspendieron en 500 µl de agua ultra
en (agar 2 g/L) a temperatura ambiente por 16 h. Las
pura, disgregado con pistilo y vortex. Los fragmentos
ascósporas se “pescaron” con jeringa de insulina y
miceliales se ajustaron en agua a 10 x 104 /mL según
se inocularon en el medio PDA, para la obtención de
(Vasquez et al., 2009), observado en cámara Neubauer
cultivos monospóricos del hongo. Del micelio se realizó
(fondo del campo central de 0.1 mm y superficie de
la extracción de ADNg, siguiendo el protocolo descrito
conteo 0.0025 mm2). En celdas de 1 mL de (12 x 12
por el fabricante DNeasy Plant Mini Kit de (QIAGEN-
x 45 mm) para espectrofotometría se añadieron 720
Start EE.UU.). La identificación de M. fijiensis se realizó
µL del medio Sabouraud con (20 g Dextrosa y 10 g
por PCR empleando los oligonucleótidos específicos
Peptona), 90 µL de la suspensión micelial y 90 µL de
MF137
(5´GGCGCCCCCGGAGGTCTCCTT
extractos bacterianos. El desarrollo micelial se verificó
3´), que amplifica la región ITS entre la región
por turbidez en longitud de onda de 600 nm (OD600nm)
ribosomal
18S y
5.8S
(Johanson,
1995) y R635
en el espectrofotómetro UNICO 1205 Vis. Se empleó
(5´GGTCCGTGTTTCAAGACGG 3´) en la región 25S
como control absoluto los 900 µl del medio Sabourand
del ADN ribosomal, de 1018 pb (Leiva et al., 2013).
como punto de inicio para su evaluación, la turbidez
del medio de cultivo se evaluó por 7, 11, 15, 19 y 22
Obtención de extractos antagónicos bacterianos
días. Los valores de turbidez del control no varían por
Las rizobacterias se incubaron en 50 mL de King
la adición del extracto celular y la suspensión micelial.
B líquido a 150 rpm a 27 °C por 48 h en un agitador
En todos los experimentos los tratamientos
(Benchmark, Incu-Shaker), recuperando
15 mL de
contenían cinco replicas experimentales y cada una
cultivo bacteriano y centrifugado a 6000 x g / 3 min
con cinco unidades experimentales. Los valores a cada
(Centrifuge
800-B), proceso realizado en triplicado
condición están representados con el error estándar
para recuperar el sobrenadante y descartar la presencia
promedio individual (±), los tratamientos fueron sujetos
de células bacterianas. Los extractos del cultivo celular
al análisis de varianza por ANOVA, y separados por
fueron filtrados empleando Nalgene Syringe de 0.2 µm
procedimiento de comparación múltiple de Tukey
y posteriormente sometidos a choque térmico de 15 min
SD, al nivel de significancia de (P≤0.05), empleando
a 90oC a baño de agua (Memmert WNB 22) y 15 min a
Statgraphics.
- 40oC en el ultra congelador (Eppendorf-Innova U725)
y almacenados a 4oC.
Resultados
Ensayo de germinación de ascósporas de M. fijiensis
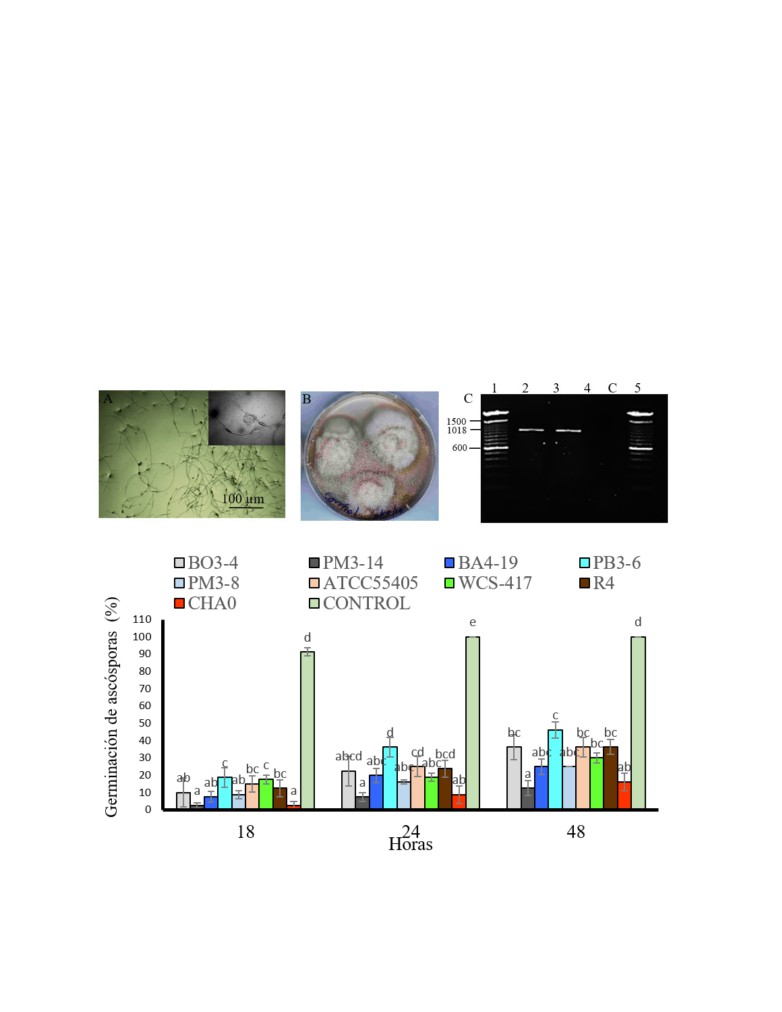
Identificación de Mycosphaerella fijiensis
Las muestras de hojas de 5 cm2 fijadas al interior de
De tejido foliar con los síntomas de la enfermedad
la tapa de la placa Petri del producto de las descargas,
se recuperaron las ascósporas de M. fijiensis (Figura
se sobrepusieron a las placas base con los extractos
1A), obteniendo cultivos monospóricos del hongo
celulares al
2% con (agar 2 g/L), empleando una
(Figura 1B) e identificando por PCR con el producto
muestra del tejido foliar para un total de 25 placas. Se
de amplificación de 1018 pb. La especificidad de la
adhirió una hoja de acetato milimetrada en la base para
reacción fue determinada al no observar amplificación
delimitar el conteo de la formación del tubo germinativo
inespecífica en el control con Fusarium oxysporum
de 10 ascósporas por cada 0.5 cm2, observado con el
(Figura 1C).
microscopio óptico BOECO objetivo 10x, incubado a
27oC para su evaluación a 18, 24 y 48 h.
Extractos celulares de PGPR con inhibición al tubo
germinativo de ascósporas
Ensayos antagonistas al desarrollo micelial de M.
El efecto inhibitorio al desarrollo del tubo
fijiensis
germinativo determinaron diferencias significativas
Se recuperó 0.2 mL de los extractos celulares y se
entre los tratamientos, donde la aplicación del extracto
homogenizaron en 9.8 mL del medio PDA y distribuidas
celular de E. asburiae PM3-14 se observó escasamente
en placas Petri, añadiendo tres discos de (1 cm Ø)
el desarrollo del tubo germinativo de (2.5 - 7.5 - 12.5 %)
micelial de M. fijiensis e incubados a 270C. Se evaluó
y con similar respuesta con la cepa control P. protegens
Ciencia y Tecnología. 2020. 13(2):9-16
11
Chávez et al., 2020
CHA0 de (2.5 - 8.75 - 16.25 %), las ascósporas sin
mostraron el desarrollo de los tubos germinativos
los extractos se verificaron la formación del 100% de
bipolar característico de M. fijiensis (Figura 3 D).
los tubos germinativos entre los tiempos de evaluación
de 18, 24 y 48 h. La aplicación de los extractos de E.
Inhibición del desarrollo micelial por extractos
asburiae BA4-19 y S. marcescens PM3-8 no superan
celulares al 2 %
el 25% germinación de las ascósporas y el aumento de
Los extractos celulares de las cepas
(PM3-14,
la tasa de germinación sobre el 30% por aplicación de
BA4-19 y PM3-8) de mayor efecto inhibitorio al tubo
los extractos de K. variicola BO3-4, P. putida PB3-6,
germinativo fueron seleccionadas para evaluar su
cepas controles P. veronii R4, P. fluorescens WCS417 y
respuesta al desarrollo micelial, observando diferencias
B. subtilis para las 48 h de evaluación (Figura 2).
significativas entre los tratamientos donde el extracto
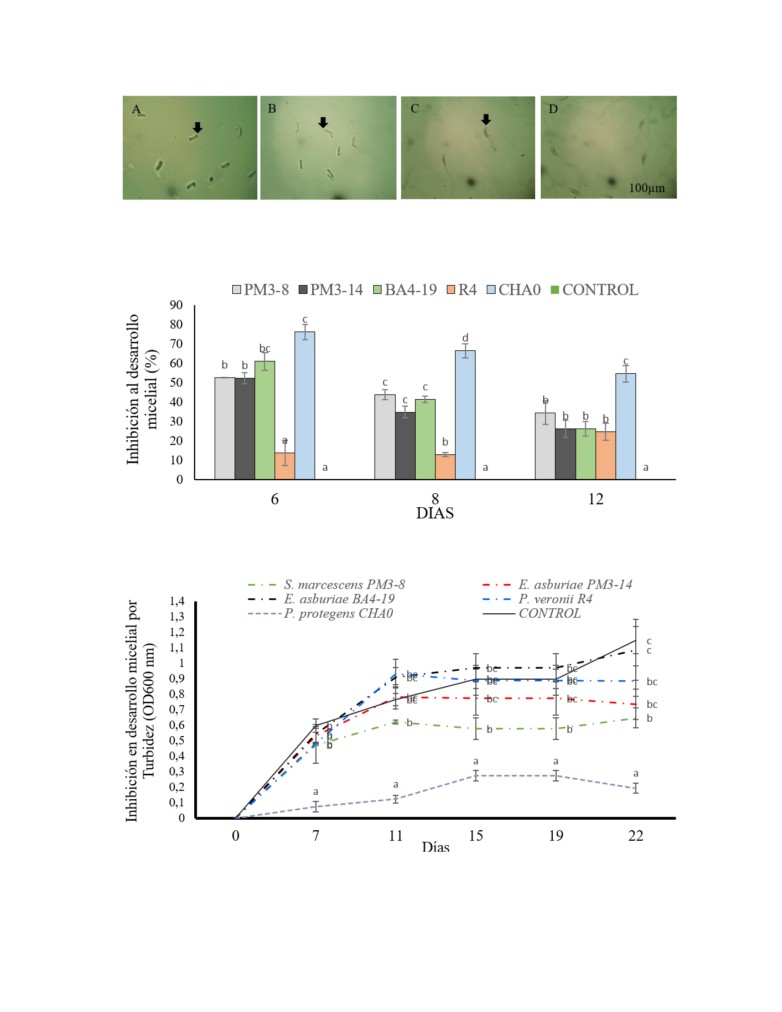
Las ascósporas presentaron anomalías en sus
celular de P. protegens CHA0 inhibe el desarrollo
caracteres morfológicos por aplicación del extracto de
micelial del hongo con (76, 66 y 54 %) a los 6, 8, 12 días.
E. asburiae PM3-14 y P. protegens CHA0 causando
El efecto de los extractos celulares de las cepas (PM3-8,
la inhibición del tubo germinativo de las ascósporas y
BA4-19 y PM3-14) refleja actividad antagónica mínima
la turgencia en ellas (Figura 3 A-B). Los extractos de
con (34, 26 y 26 %), a los 12 días. La cepa control
las cepas nativas E. asburiae BA4-19 y S. marcescens
P. veronii R4 no supera el 25 % al doceavo día, sin
PM3-8 mostraron elongación anormal de un solo tubo
aplicación del extracto se verifica un normal desarrollo
germinativo (Figura 3 C), sin aplicación del sobrenadante
micelial del hongo (Figura 4).
Figura 1. Identificación de Mycosphaerella fijiensis
Figura 2. Inhibición del tubo germinativo en ascósporas de M. fijiensis. Se evaluó los extractos al 2% al
desarrollo del tubo germinativo de ascósporas a 18, 24 y 48 h. Los valores con letras similares no presentan
diferencias estadísticas significativas al nivel de (P≤0.05), por el procedimiento de comparación múltiple de
Tukey. Las barras indican el ES individual para tratamiento (±).
12
Ciencia y Tecnología. 2020. 13(2):9-16
Rizobacterias con potencial antagonista in vitro a Mycosphaerella fijiensis Morelet
Figura 3. Efecto de los extractos en inhibición al desarrollo del tubo germinativo de ascósporas. A
No germinación de las ascósporas tratadas con E. asburiae PM3-14, B Aplicación de P. fluorescens CHA0,
C Germinación anormal de las ascósporas con un tubo germinativo por efecto de E. asburiae BA4-19, D
Ascósporas no tratadas con germinación normal de M. fijiensis observadas bajo microscopio a (10 x), después
de 48 h. Las flechas marcan el efecto inhibitorio a la formación del tubo germinativo.
Figura 4. Efecto antagónico de extractos celulares al 2 % en desarrollo micelial. Los valores con letras
similares no presentan diferencias estadísticas significativas al nivel de (P≤0.05), por el procedimiento de
comparación múltiple de Tukey. Las barras indican el ES individual para tratamiento (±).
Figura 5. Extracto al 10 % en cinética de inhibición al desarrollo micelial. Desarrollo micelial en medio
líquido Sabouraud post-incubado por 7, 11, 15, 19 y 22 días. Los resultados son expuestos y analizados por
día de incubación, los valores con letras similares no presentan diferencias estadísticas significativas al nivel
de (P≤0.05), por el procedimiento de comparación múltiple de Tukey. Las barras indican el ES individual para
tratamiento (±).
Ciencia y Tecnología. 2020. 13(2):9-16
13
Chávez et al., 2020
Inhibición del desarrollo micelial con extractos
similares son encontrados por Vasquez et al. (2009) con
celulares al 10 %
una concentración de 80µg/ml del péptido IC75 causó
Los resultados en cinética de inhibición al desarrollo
anomalías al tubo germinativo y otras ascósporas no
micelial por aplicación de los extractos celulares al
germinan.
10%, se observaron diferencias significativas entre
El efecto inhibitorio de los extractos de P. protegens
ellas. El extracto celular de P. protegens CHA0 registró
CHA0 y S. marcescens PM3-8 sobre el micelio del hongo,
la mayor inhibición al desarrollo micelial con niveles de
se atribuye a la producción del conjunto de metabolitos
turbidez de 0.272 a los (15 y 19 días) que disminuyen
extracelulares a Proteasa, HCN y 2,4-DAPG, al entrar
gradualmente hasta
0.19
(OD600nm) al día
22. La
en contacto con el hongo, impiden su desarrollo radial
cepa nativa S. marcescens PM3-8 tiene efectividad en
normal. Cuando los metabolitos extracelulares son
inhibición micelial con niveles de turbidez de (0.472;
separados reducen el desarrollo micelial de M. fijiensis
0.620;
0.577;
0.577 y 0.47 OD600nm) que verifican
(Castillo et al.,
2016). El rendimiento anti-fúngico
su respuesta antagónica. La actividad del extracto E.
efectivo del sobrenadante de S. marcescens PM3-8 a M.
asburiae PM3-14 es mínima con niéveles de turbidez
fijiensis requirió la acción combinada de los metabolitos
de 0.530 (OD600nm) al quinto día y manteniéndose en
extracelulares y fracción proteica de quitinasas. Las
0.736 (OD600nm) al día 22. La cepa nativa E. asburiae
rizobacterias también sintetizan una variedad de
BA4-19 no ejerce cambios al desarrollo del micelio
quitinasas extracelulares que juegan un papel clave en
siendo similares al control
(Figura
5). El control
el control biológico de patógenos fúngicos (Herrera y
presentó niveles de turbidez de (0.541; 0.910; 0.971;
Chet, 1999). Se puede considerar que los metabolitos
0.971 y 1.087 OD600nm) a sus días de evaluación (7, 11,
secundarios de P. protegens CHA0 y S. marcescens
15, 19 y 22).
PM3-8 presentes en los extractos celulares actúan en la
fase sexual y asexual del ciclo productivo de M. fijiensis,
Discusión
en el tubo germinativo y crecimiento radial del micelio.
Estos metabolitos secundarios serian similares a los
el Banco de Germoplasma del Laboratorio
fungicidas sintéticos como los triazoles que inhiben la
D
de Microbiología de la UTEQ, de las cepas
bio-síntesis de ergosterol (Ma y Michailides, 2005).
seleccionadas: P. putida PB3-6, K. variicola BO3-4, E.
La mayor efectividad antagónica por los 22 días
asburiae BA4-19, S. marcescens PM3-8, E. asburiae
de exposición con los extractos celulares al 10 % de
PM3-14 mostraron tener actividad proteolítica y emitían
P. protegens CHA0 y S. marcescens PM3-8 logra la
fluorescencia igual a los controles P. protegens CHA0,
inhibición del desarrollo micelial de M. fijiensis, donde
P. veronii R4 y P. fluorescens WCS417. Los metabolitos
los metabolitos producido por las bacterias poseen una
secundarios son un componente clave de la respuesta
naturaleza anfifílica que interviene en la integridad
antagónica de las rizobacterias a patógenos del suelo,
de membrana biológica, formando poros que generan
donde la proteasa es una enzima que degrada la pared
perturbaciones osmóticos o el rompimiento de la
celular al patógeno, enzimas hidrolíticas que actúan
membrana celular (Ongena y Jacques, 2007).
como factores biocontroladores (Infante et al., 2009).
Las perspectiva en el futuro se concentrarían en la
La efectividad de los extractos celulares al 2 % de
aplicación de estos microorganismos endofíticos que
las cepas nativas PM3-14, PM3-8 y BA4-19) impiden
beneficiaran a las plantas en diferentes mecanismos
la formación al desarrollo del tubo germinativo de las
bioquímicos (Khan et al., 2008). La colonización de
ascósporas. Esto coincide con Castillo et al. (2016),
raíces por cepas no patogénicas PGPR, dan paso a
donde la aplicación del extracto de Streptomyces
la Resistencia Sistémica Inducida (RSI) a través de
galilaeus CFFSUR-B12 inhibe el desarrollo del
un mecanismo de defensa dependiente Jasmonato/
tubo germinativo de ascósporas de M. fijiensis. La
Etileno (Ton et al., 2002). Donde las aplicaciones de
efectividad de P. protegens CHA0 en inhibición del
P. protegens CHA0 en cultivar de banana Virupakshi
tubo germinativo de M. fijiensis está vinculado a la
(Musa spp. AAB), mejoran significativamente el
producción del
2,4-DAPG, donde este antibiótico
rendimiento de racimos y mantienen actividad
inhibe un amplio espectro de hongos patogénicos
antagonista a los patógenos (Kavino et al., 2010). Por
(Ahmadzadeh y Tehrani, 2009). El potencial antagónico
lo tanto, es importante llevar a cabo investigaciones que
de las PGPR se ha enfocado en su capacidad de producir
permitan la identificación de metabolitos secundarios a
compuestos anti-fúngicos estos actúan en su estructura
producción de sideroforos y reguladores de crecimiento
celular del patógeno (Kim et al., 2003). Las ascósporas
a las cepas nativas de PM3-8, PM3-14 y BA4-19P
presentaron anomalías en sus caracteres morfológicos:
para estudiar el mecanismo de acción en banano y su
turgencia en las ascósporas, elongación anormal y un
respuesta en RSI.
solo tubo germinativo y otras no germinaron. Resultados
14
Ciencia y Tecnología. 2020. 13(2):9-16
Rizobacterias con potencial antagonista in vitro a Mycosphaerella fijiensis Morelet
Conclusión
Characterization of a bacterial biocontrol strain B106 and
its efficacies on controlling banana leaf spot and post-
as bacterias provenientes de la rizósfera de
harvest anthracnose diseases. Biological Control, 55(1),
L
musáceas, de actividad proteolítica y productoras
de HCN por E. asburiae PM3-14 se destaca por alterar
Galarza, L., Akagi, Y., Takao, K., Kim, C., Maekawa, N.,
el tubo germinativo de ascósporas con el 80 %. En
Itai, A., Peralta, E., Santos. E., y Kodama, M. (2015).
inhibición al desarrollo del micelial S. marcescens
Characterization of Trichoderma species isolated
PM3-8 y E. asburiae PM3-14 tiene el mayor efecto con
in Ecuador and their antagonistic activities against
34.51 %. Las rizobacterias estarían participando con
phytopathogenic fungi from Ecuador and Japan. Journal
gran efectividad antagonista en la etapa inhibición del
tubo germinativo y el desarrollo micelial de M. fijiensis.
org/10.1007/s10327-015-0587-x
Herrera, A., y Chet, I. (1999). Chitinases in biological control.
Agradecimientos
Birkhauser Verlag Basel/Switzerland, 171-183.
Infante, D., Martínez, B., González, N., y Reyes, Y. (2009).
l trabajo se financió por el Proyecto de la Quinta
Mecanismo de acción de Trichoderma frente a hongos
E
Convocatoria FOCICYT-2018
(Pseudomonas
fitopatógenos. Revista de Protección Vegetal,
24(1),
spp con actividad antagonista hacia Meloidogyne
14-21.
incognita en Lycopersicum esculentum), otorgado por
Johanson, A. (1995). Detection of banana leaf spot pathogens
la Universidad Técnica Estatal de Quevedo.
by PCR. Bulletin OEPP, 25(12), 99-107.
Kavino, M., Harish, S., Kumar, N., Saravanakumar, D., y
Literatura citada
Samiyappan, R. (2010). Effect of chitinolytic PGPR on
growth , yield and physiological attributes of banana (
Aguilar, F., y Kohlmann, B. (2006). Willingness to consume
Musa spp .) under field conditions. Applied Soil Ecology,
and produce transgenic bananas in Costa Rica.
International Journal of Consumer Studies, 30(6), 544-
Khan, Z., Kim, S., Jeon, Y., Khan, H., Son, S., y Kim, Y. (2008).
A plant growth promoting rhizobacterium, Paenibacillus
Ahmadzadeh, M., y Tehrani, A.
(2009). Evaluation of
polymyxa strain GBR-1 , suppresses root-knot nematode.
fluorescent pseudomonads for plant growth promotion
, antifungal activity against Rhizoctonia solani on
org/10.1016/j.biortech.2007.06.031
common bean , and biocontrol potential. Biological
Kim, H., Park, J., Choi, S., Choi, K., Lee, G., Ban, S., Lee,
Control,
48(7),
C., y Kim, C. (2003). Isolation and characterization of
biocontrol.2008.10.012
Bacillus strains for biological control. The Journal of
Amil, F., Heaney, S., Stanger, C., y Shaw, M. (2007). Dynamics
Microbiology, 41(3), 196-201.
of QoI Sensitivity in Mycosphaerella fijiensis in Costa
King, E., Ward, M., y Raney, D.
(1954). Two simple
Rica During 2000 to 2003. Phytopathology, 97(11),
media for the demonstration of pyocyanin and
fluorescin. The Journal of Laboratory and Clinical
Castillo, B., Dunn, M., Navarro, K., Melendez, F., Ortiz,
Medicine,
44(2),
M., Guevara, S., y Palacios, G.
(2016). Antifungal
URI:PII:002221435490222X
performance of extracellular chitinases and culture
Leiva, M., Portal, O., Alvarado, Y., Acosta, M., Cruz, M.,
supernatants of Streptomyces galilaeus CFFSUR-B12
Sánchez, C., Rojas, L., y Roque, B. (2013). Identificación
against Mycosphaerella fijiensis Morelet. World Journal
molecular de aislados cubanos de Mycosphaerella
of Microbiology and Biotechnology, 32(3), 1-12. https://
fijiensis Morelet. Revista Protección Vegetal,
28(3),
doi.org/10.1007/s11274-015-1993-0
229-231.
Döbereiner, J., Baldani, V., y Reis, V. (1995). Endophytic
Ma, Z., y Michailides, T. (2005). Advances in understanding
occurrence of diazotrophic bacteria in Non-Leguminous
molecular mechanisms of fungicide resistance
crops. In Azospirillum VI and Related Microorganisms
and molecular detection of resistant genotypes in
(pp.
3-14). Berlin, Heidelberg: Springer Berlin
phytopathogenic fungi. Crop Protection, 24(7), 853-
8_1
Marin, D., Romero, R., Guzmán, M., y Sutton, T. (2003). Black
Dwivedi, D., y Johri, B. (2003). Antifungals from fluorescent
Sigatoka: An increasing threat to banana cultivation.
pseudomonads:
Biosynthesis
and
regulation.
Plant Disease, 87(3).
Current Science,
85(12),
Ongena, M., y Jacques, P. (2007). Bacillus lipopeptides :
org/10.2307/24109974
versatile weapons for plant disease biocontrol. Trends in
Fu, G., Huang, S., Ye, Y., Wu, Y., Cen, Z., y Lin, S. (2010).
Ciencia y Tecnología. 2020. 13(2):9-16
15
Chávez et al., 2020
tim.2007.12.009
Pérez, L., Hernández, A., Hernández, L., y Pérez, M. (2002).
Effect of trifloxystrobin and azoxystrobin on the control
of black Sigatoka (Mycosphaerella fijiensis Morelet)
on banana and plantain. Crop Protection, 21(1), 17-23.
Proecuador.
(2016). Análisis sectorial banana. Retrieved
htm%0AAnálisis
Romero Calderon, R. (1995). Dynamics of fungicide resistant
populations of Mycosphaerella fijiensis and epidemiology
of black Sigatoka of bananas. Red Internacional para el
Mejoramiento del Banano y Plátano, (INIBAP).
Romero, R., y Sutton, T. (1998). Characterization of benomyl
resistance in Mycosphaerella fijiensis, cause of Black
Sigatoka of banana, in Costa Rica. Plant Disease, 82(8),
Ton, J., Pelt, J. A. Van, Loon, L. C. Van, y Pieterse, C. (2002).
Differential effectiveness of salicylate-dependent and
jasmonate/ethylene-dependent Induced Resistance in
Arabidopsis. The American Phytopathological Society,
15(1), 27-34.
Vasquez, L., Guzman, F., Elkin, M., y Arango, R. (2009).
In vitro evaluation of antimicrobial peptides against
Mycosphaerella fijiensis Morelet and their interaction
with some chemical fungicides. Revista
- Facultad
Nacional de Agronomia Medellin, 62(2), 5063-5069.
16
Ciencia y Tecnología. 2020. 13(2):9-16